Bohr começou por presumir que os elétrons em órbita não descreviam movimento em espiral em direção ao núcleo. Isto contradizia tudo que se conhecia de eletricidade e magnetismo, mas adaptava-se ao modo pelo qual as coisas aconteciam.
Nesta ocasião Bohr determinou suas duas leis para o que realmente ocorre.
Primeira Lei: os elétrons podem girar em órbita somente a determinadas distâncias permitidas do núcleo.
Este é um comportamento muito diferente daquele dos objetos que nos cercam. Suponha que uma bola arremessada de uma sala só pudesse seguir 2 ou 3 trajetos determinados, em vez das centenas de trajetos diferentes que ela realmente pode seguir. Seria como se a sala tivesse trajetos invisíveis orientando a bola. Assim, a lei de Bohr afirma que os elétrons agem como se o espaço ao redor do núcleo atômico possuísse trajetos invisíveis. Mas Bohr não deu justificativa para esta estranha situação.
Segunda Lei: um átomo irradia energia quando um elétron salta de uma órbita de maior energia para uma de menor energia.
Além disso, um átomo absorve energia quando um elétron é deslocado de uma órbita de menor energia para uma órbita de maior energia.
Em outras palavras, os elétrons saltam de uma órbita permitida para outra à medida que os átomos irradiam ou absorve energia. As órbitas externas do átomo possuem mais energia do que as órbitas internas. Por conseguinte, se um elétron salta da órbita 2 para a órbita 1, há emissão de luz, por outro lado, se luz de energia adequada atingir o átomo, esta é capaz de impelir um elétron da órbita 1 para a órbita 2. Neste processo, a luz é absorvida.
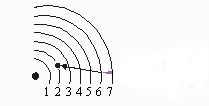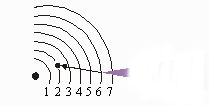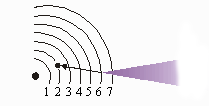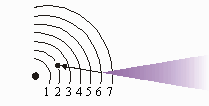
A linha vermelha no espectro atômico é causada por elétrons saltando da terceira órbita para a segunda órbita.
A linha verde-azulada no espectro atômico é causada por elétrons saltando da quarta órbita para a segunda órbita.
A linha azul no espectro atômico é causada por elétrons saltando da quinta órbita para a segunda órbita.
A linha violeta mais brilhante no espectro atômico é causada por elétrons saltando da sexta órbita para a segunda órbita.
É interessante notar que os comprimentos de onda da luz encontrada no espectro do hidrogênio corresponde à diferentes órbitas. (O comprimento de onda guarda relação com a energia. Os menores comprimentos de onda de luz significam vibrações mais rápidas e maior energia). Por exemplo, a linha verde-azulada no espectro linear do hidrogênio é causada por elétrons que saltam da Quarta órbita para a Segunda órbita. A figura mostra como cada linha no espectro resulta de um determinado salto de elétrons







Nenhum comentário:
Postar um comentário